Accueil > Nos conseils & astuces > La méthylation : c’est quoi et à quoi ça sert ?
La méthylation : c’est quoi et à quoi ça sert ?
Qu’est-ce que la méthylation ? Très peu de gens le savent, alors que c’est la clé de voûte d’une multitude d’actions vitales au sein de notre organisme. Ce processus essentiel notamment pour le cerveau et la santé mentale et qui peut être la cause de nombreux symptômes et pathologies, peut faire défaut aux végétariens et aux vegans (mais aussi aux omnivores). On vous explique tout ça en détail dans cet article ultra complet. Allez, on s’accroche, et pour les plus pressés, rendez-vous directement à la conclusion !
Par Patrick, Co-fondateur de nutriting et expert en nutrition
Publié le 23 mars 2023, mis à jour le 24 octobre 2023
Qu’est-ce que la méthylation ?
La méthylation : un processus vital qui assure une multitude de fonctions dans le corps
La méthylation est un processus métabolique vital. Il a lieu en permanence dans toutes les cellules de notre organisme à un rythme effréné (jusqu’à un milliard de fois par seconde). Biochimiquement, il s’agit d’un processus extrêmement simple qui consiste en la transmission d’un groupe méthyle (un atome de carbone lié à 3 atomes d’hydrogènes, ou CH3) d’une molécule à une autre.
Mais ce procédé, simple en apparence, permet à lui seul d’assurer une multitude de fonctions dans le corps humain, comme la production et la régulation de très nombreuses molécules dont des neurotransmetteurs et hormones dans le cerveau, la détoxification du corps via la production de glutathion (qui n’est autre que l’antioxydant le plus puissant du corps humain), la dégradation de l’histamine dans l’intestin.
Mais aussi et surtout, selon l’une des grandes découvertes de ces dernières années, il permet la modulation de l’expression de certains gènes de notre ADN via des processus épigénétiques.
L’épigénétique, qu’est-ce que c’est ?
Comme on peut le lire sur le site de l’INSERM1 :
Alors que la génétique correspond à l’étude des gènes, l’épigénétique s’intéresse à une « couche » d’informations complémentaires qui définit comment ces gènes vont être utilisés par une cellule ou… ne pas l’être.
Dit autrement (et en simplifiant la chose), nous héritons d’un patrimoine génétique de nos parents. Ces gènes nous prédisposent à certaines choses, qu’elles soient positives (comme certaines capacités physiques) ou négatives (comme certaines pathologies). Jusqu’à récemment, nous pensions que nous ne pouvions pas échapper à cet héritage, et que nous subissions l’influence de nos gènes quoi qu’il advienne.
L’épigénétique est une science nouvelle, elle montre au contraire que les gènes ne sont que des prédispositions, mais que leur influence dépendra entièrement de notre mode de vie : l’alimentation, le stress, les pensées, la pollution environnante, etc.
La capacité des gènes à s’exprimer ou non, en fonction du mode de vie, dépendra ainsi entièrement de la méthylation.
Un défaut de méthylation à l’origine de nombreuses pathologies
La méthylation est donc indispensable pour l’entretien, la réparation et la fabrication de nos cellules, la communication intracellulaire, et plus particulièrement, l’héritage d’informations épigénétiques d’une cellule mère aux cellules filles lors de la division cellulaire (qui est le mode de reproduction des cellules).
On soupçonne des défauts de méthylation d’être à l’origine d’une grande quantité de pathologies très variées, allant de l’autisme à Alzheimer, en passant par les troubles de l’anxiété, les crises d’angoisses, les troubles déficitaires d’attention avec ou sans hyperactivité, et bien d’autres. Il est donc primordial de maintenir un bon niveau de méthylation dans le corps.
Ce processus essentiel est fonction de deux paramètres principaux :
- Les facteurs environnementaux, en particulier l’alimentation,
- Les facteurs génétiques.
En bref
La méthylation est un processus clé de notre corps, qui a lieu de manière naturelle tout le temps et partout dans notre organisme. Un défaut dans ses rouages, et cela peut être la cause d’innombrables symptômes et pathologies sérieuses. Il est donc important de comprendre comment tout ceci fonctionne, et de savoir si l’on est concerné par un mauvais fonctionnement, qu’il soit hérité ou induit.
Comment fonctionne la méthylation ?
Au commencement de la méthylation, le cycle de la méthionine
La méthionine, un acide aminé essentiel au cœur de la méthylation
Au cœur de la méthylation se trouve un acide aminé essentiel : la méthionine. Sans elle, pas de méthylation possible !
La méthionine est présente dans toutes les sources de protéines, mais particulièrement abondante dans les protéines animales.
Comme son nom l’indique, la méthionine comporte donc ce fameux élément essentiel : un groupe méthyle (qui comme expliqué en introduction, n’est ni plus ni moins qu’un atome de carbone lié à 3 atomes d’hydrogènes).
La transformation de la méthionine en SAM
Cependant en l’état, la méthionine ne peut céder son groupe méthyle à une autre molécule. Il faudra avant cela qu’elle se transforme (en se combinant avec une molécule d’ATP) en sa forme métaboliquement active appelée S-adénosyl-L-méthionine, ou SAM.
Pour rappel, l’ATP (pour Adénosine TriPhosphate) est une molécule clef qui fournit l’énergie nécessaire à toutes les cellules de notre corps (métabolisme, locomotion, division cellulaire, transport, etc.). C’est donc en quelque sorte la particule énergétique élémentaire et universelle, sans laquelle rien n’est possible dans le corps humain.
La SAM ainsi formée va alors devenir l’un des principaux donneurs de groupes méthyles du corps humain :
- On estime qu’environ 80% des processus de méthylation auxquels elle participe ne servent qu’à la fabrication de deux composants (ou familles) indispensables et essentiels pour le cerveau : la créatine et la phosphatidylcholine.
- Les 20% restants représentent donc des centaines de réactions, parmi lesquelles celles que nous avons évoquées en introduction.
La dégradation de la SAM en homocystéine
Une fois son groupe méthyle cédé, la SAM, devenue alors SAH (pour S-adénosyl-L-homocystéine), se dégradera en homocystéine (en libérant sa molécule d’ATP précédemment acquise).
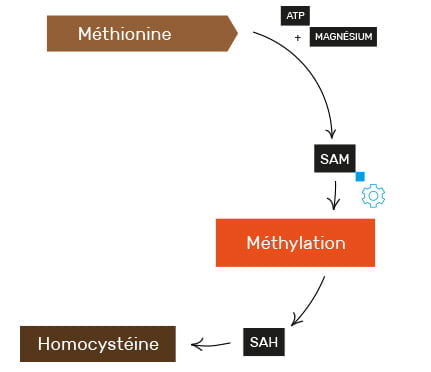
Si l’homocystéine ainsi créée peut s’avérer dangereuse en excès (nous le verrons dans la partie suivante), c’est également le cas de la méthionine. En effet, trop de méthionine donnera trop de SAM, et il y a alors risque d’hyperméthylation.
Le rôle de la glycine pour éviter l’hyperméthylation
Pour éviter cela, la glycine (un acide aminé présent essentiellement dans la peau et les os) sera utilisée au gré des besoins pour dégrader la SAM en SAH également, et ainsi éviter une méthylation excessive non souhaitable. La glycine est donc particulièrement importante pour son rôle tampon dans ce processus.
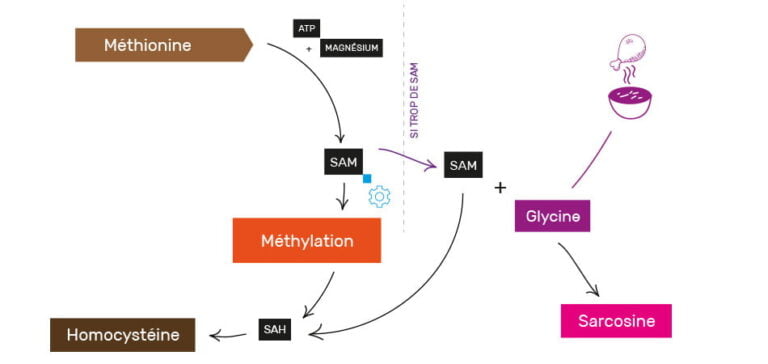
On voit donc déjà ici que plus nous consommons de méthionine, plus nous allons fabriquer de SAM, et plus nous avons besoin de glycine pour tamponner l’excès de SAM.
Méthylation : la fin du cycle de la méthionine et l’excès d’homocystéine
L’homocystéine est connue pour être un marqueur du risque cardiovasculaire, mais également (et plus récemment) neuropsychiatrique. De fait, bien que nécessaire au déroulement de certains processus, son accumulation n’est pas souhaitable, car elle pourrait provoquer des lésions des cellules endothéliales (les cellules qui constituent l’endothélium, la couche intérieure des veines qui est en contact avec le sang).
Ainsi, un taux trop élevé d’homocystéine doit immédiatement alerter, non seulement car en soi l’accumulation de cette molécule pourrait s’avérer dangereuse, mais surtout car il est signe d’un dérèglement du cycle de méthylation, et peut donc entraîner des conséquences pathologiques sérieuses.
Heureusement, l’homocystéine a 3 voies biologiques pour se reconvertir :
- Deux de ces voies vont servir à recycler l’homocystéine en méthionine, car l’homocystéine n’est ni plus ni moins qu’une molécule de méthionine sans son groupe méthyle ! Il suffit donc de lui rajouter un groupe méthyle pour « re-fabriquer » la méthionine d’origine, et le cycle repart.
- La troisième voie servira à fabriquer du glutathion à partir de l’homocystéine.
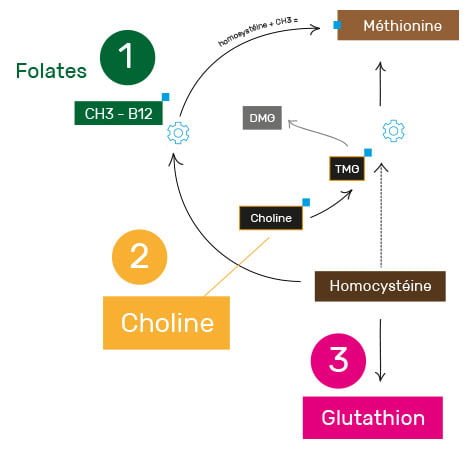
En bref
La méthylation commence par la méthionine, un acide aminé essentiel présent dans la viande, le poisson, les œufs, les laitages, le soja, etc. Après quelques transformations, la méthionine est donc utilisée dans le processus de méthylation pour fabriquer de nombreux composés essentiels pour le cerveau.
Elle sera alors dégradée en homocystéine, un composé qui, lorsqu’il s’accumule, peut devenir extrêmement toxique pour l’organisme, mais surtout qui indique un problème dans le cycle de méthylation. En ce sens, l’excès d’homocystéine est donc un premier indicateur qui alerte sur une méthylation problématique.
Une fois l’homocystéine créée, l’organisme va donc devoir la recycler d’urgence à travers divers processus. Deux de ces processus vont régénérer de la méthionine à partir de l’homocystéine ; un dernier processus se servira de l’homocystéine pour fabriquer le gluthation.
Méthylation : les 3 voies de recyclage de l’homocystéine
Comment alors se procurer un groupe méthyle, puisqu’il vient d’être cédé ?
1. La 1ère voie de recyclage via le cycle des folates
La voie royale passe par ce qu’on appelle le cycle des folates. Lorsque l’on ingère des folates (communément regroupées dans la vitamine B9) via notre alimentation, ou de l’acide folique synthétique dans certains compléments, ceux-ci vont subir de multiples transformations enzymatiques dans le but de recevoir un groupe méthyle.
La forme finale et métaboliquement active s’appelle 5-méthyltétrahydrofolate, ou plus simplement 5-MTHF.
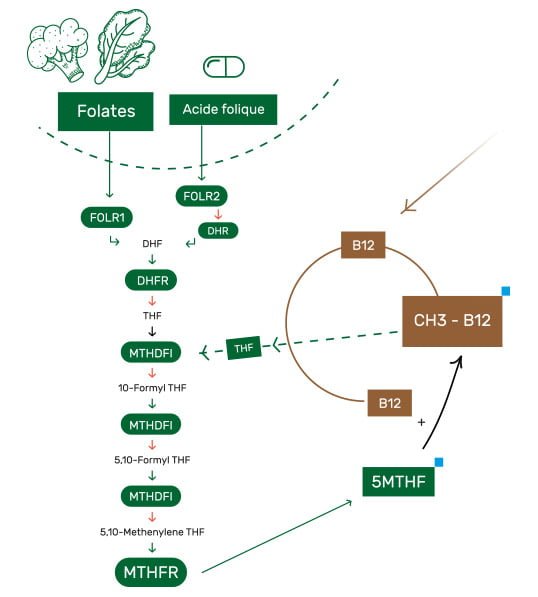
Le 5-MTHF devient alors donneur de groupe méthyle pour la vitamine B12, qui de simple cobalamine (= forme de base), passe alors à l’état de méthylcobalamine (= cobalamine + groupe méthyle).
Cette forme peut enfin transmettre à son tour son groupe méthyle tout juste acquis à l’homocystéine, ce qui permettra donc de recycler la méthionine.
La cobalamine résultante attendra, elle, un nouveau groupe méthyle provenant du cycle des folates. Le 5-MTHF, devenu lui simple tétrahydrofolate (THF), retournera également dans le cycle pour pouvoir à nouveau recevoir un groupe méthyle. Et ainsi de suite, là encore.
Evidemment, ce cycle ne fonctionne pas en vase clos, et les nutriments (folates, vitamine B12, etc.) finissent tôt ou tard par être dégradés, ou utilisés dans d’autres processus, d’où l’importance d’en apporter suffisamment et continuellement.
Le saviez-vous ?
Pour faire le plein de folates et de vitamine B12, évidemment il y a notre multivitamines star nuPower ! Et si vous ne le connaissez pas encore, en gros c’est le multi le plus complet pour avoir tous les micronutriments essentiels, à dosages 100% physiologiques et sous leurs formes métaboliquement actives.
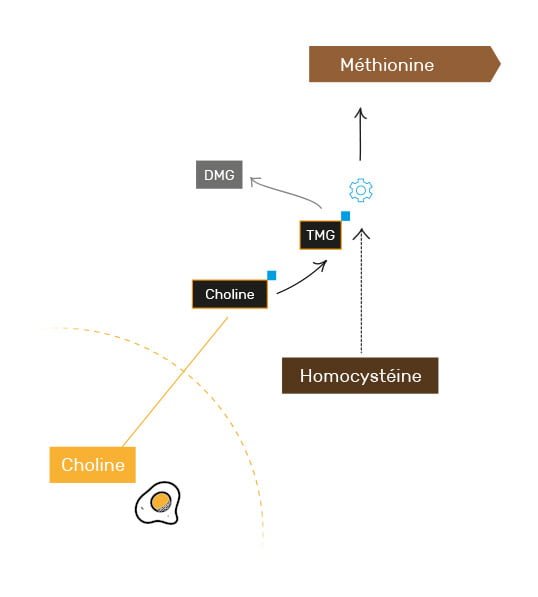
2. La 2ème voie de recyclage via la choline
La deuxième voie de recyclage utilise, elle, de la choline, un autre nutriment que l’on classe souvent parmi les vitamines B.
La choline possède déjà un groupe méthyle, mais devra elle aussi être convertie dans une forme « active » appelée triméthylglycine (ou TMG), avant de pouvoir le transmettre (la TMG est parfois abusivement appelée bétaïne, les bétaïnes représentant en réalité un ensemble de composés).
La TMG cèdera alors l’un de ses 3 groupes méthyles à l’homocystéine, et le cycle de la méthionine pourra ainsi continuer.
3. La 3ème voie de recyclage ou voie de transsulfuration
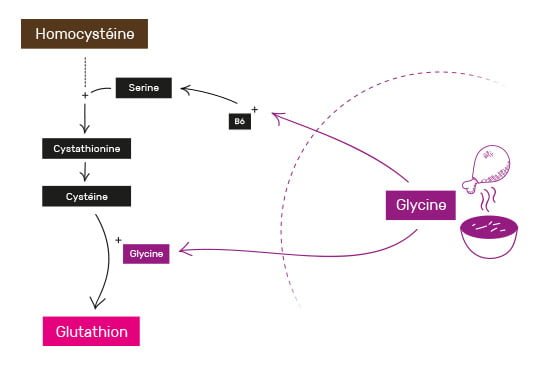
La dernière voie de reconversion de l’homocystéine est aussi la plus importante. Nommée voie de transsulfuration (il ne s’agit plus de cycle ici), elle est utilisée pour créer des composants vitaux comme la taurine, mais aussi et surtout, le principal antioxydant du corps humain : le glutathion (aussi appelé GSH).
L’homocystéine va d’abord être catabolisée (= dégradée) via plusieurs transformations nécessitant de la vitamine B6, ainsi que de la sérine (un acide aminé très abondant dans les protéines), pour donner de la cystéine.
Cette dernière va alors s’adjoindre d’abord à l’acide glutamique (ou glutamate sous sa forme ionique, un autre acide aminé), puis à de la glycine, pour former le fameux glutathion. La taurine quant à elle sera fabriquée plus tard dans le cycle.
En bref
Il existe donc 3 voies pour recycler l’homocystéine :
- La première repose sur les folates et la vitamine B12, qui après de multiples transformations enzymatiques, vont pouvoir retransformer l’homocystéine en méthionine, et le cycle initial de repartir.
- La deuxième repose sur la choline, un nutriment essentiel généralement rangé dans la classe des vitamines B, qui lui aussi subira quelques transformations avant de pouvoir régénérer l’homocystéine en méthionine à nouveau.
- Enfin, la dernière voie va transformer l’homocystéine en composés essentiels comme la taurine ou le glutathion, le plus puissant antioxydant du corps humain, grâce à l’intervention de multiples nutriments, en particulier la glycine.
Le fonctionnement du processus de méthylation en résumé
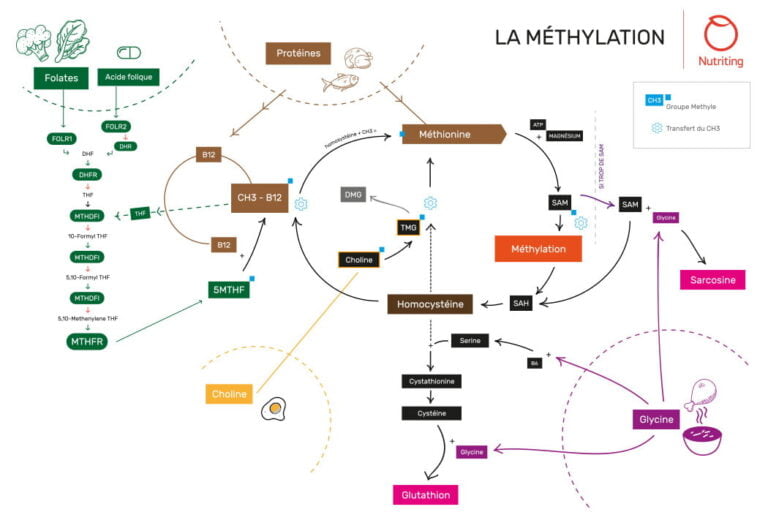
Pour clarifier tout ce que nous venons d’expliquer, la méthylation n’est rien de plus que la transmission d’un groupe d’atomes CH3 (appelé groupe méthyle) d’une molécule à une autre.
Bien que de nombreuses molécules possèdent un ou plusieurs groupes méthyles, elles ne peuvent pas le céder à n’importe quelle autre molécule, et souvent, une molécule donnée fournira son groupe méthyle à une autre molécule donnée, qui le fournira à son tour à une autre, etc.
Un peu comme une chaîne humaine se passant de main en main le fameux Graal, chaque donneur ayant un receveur attitré, qui devient à son tour donneur pour un autre receveur attitré, etc. Si une personne manque dans le cycle, c’est tout le cycle qui s’effondre.
Ainsi par exemple, les folates vont devenir methyl-folates pour pouvoir donner leur groupe méthyle à la vitamine B12, qui à son tour le donnera à l’homocystéine, qui deviendra alors méthionine, puis cette dernière donnera son groupe méthyle pour de nombreuses réactions (sous sa forme SAM) avant de redevenir homocystéine, qui pourra à nouveau accepter un groupe méthyle de la part de la vitamine B12, et ainsi de suite.
Ce mécanisme indique l’étroite imbrication entre les différents cycles et voies de méthylation, et les nutriments desquels ils dépendent. Bien qu’indispensable à l’ensemble de ces processus, la méthionine subit une conversion en homocystéine qui, si elle s’accumule en excès, peut devenir délétère.
Il est donc indispensable qu’elle soit recyclée par des voies métaboliques qui font appel à d’autres nutriments essentiels : folates, vitamines B12 et B6, choline ou TMG (ou triméthylglycine) et glycine en particulier.
Schéma complet du processus de méthylation
Quels sont les facteurs qui influencent la méthylation ?
Les carences dans notre alimentation : quelles conséquences sur la méthylation ?
A ce stade, il est aisé de comprendre que si l’un de ces nutriments vient à manquer, c’est tout le cycle qui en subit les répercussions, conduisant potentiellement à une augmentation de l’homocystéine, et à tous les effets délétères qu’elle peut engendrer.
Méthylation : attention à la carence en vitamine B12 chez les végétariens et vegans
En particulier, une carence en vitamine B12 empêche le recyclage de l’homocystéine, bloquant ainsi le bon déroulement des processus de méthylation.
Les végétariens (et a fortiori les végétaliens) chez qui ce type de carence peut régulièrement être constatée2,3, devraient donc être particulièrement vigilants sur cet aspect.
Méthylation : attention à la carence en folates et glycine chez les omnivores
Mais les omnivores ne sont pas en reste, car leurs diètes habituelles sont souvent déficitaires en deux nutriments essentiels à ce processus : les folates, mais aussi et surtout la glycine.
En effet, le rôle de la glycine est de transformer l’excès d’homocystéine en glutathion, ainsi que de tamponner l’excès de méthionine. De ce fait, plus on consomme de la viande, et surtout de la viande maigre, plus nos besoins en glycine augmentent (car étant donné que la viande contient beaucoup de méthionine, l’essentiel de la glycine va être utilisée pour tamponner l’excès qui provient de cette consommation).
Or, la glycine se trouvant essentiellement sous forme de collagène dans la peau et les os (qui ne sont plus tellement consommés de nos jours), les carences en glycine ne sont pas rares.
Les facteurs génétiques qui influencent la méthylation
La méthylation est liée à notre patrimoine génétique
En plus de l’alimentation, la méthylation est étroitement liée à notre patrimoine génétique. En effet, des dizaines et des dizaines de gènes codent pour autant d’enzymes qui sont impliqués dans les divers cycles et voies de méthylation. Ces gènes peuvent présenter de nombreuses variations que l’on appelle « mutations ».
Lorsque la mutation ne touche qu’une seule des deux allèles (ou “versions”) codant pour le gène en question (puisque nous héritons de deux versions de chaque gène provenant de chacun de nos parents), la mutation est dite hétérozygote, et l’enzyme concernée ne verra son activité que partiellement réduite (ou accélérée).
Mais lorsque la mutation touche les deux allèles, elle est dite homozygote, et l’enzyme impactée peut alors voir son activité drastiquement atteinte.
La mutation du gène MTHFR et son impact sur la méthylation
L’un des exemples les plus connus concerne le gène MTHFR, qui code pour l’enzyme du même nom. Cette enzyme est située tout en bout de chaîne du cycle des folates, et sert à la fabrication du précieux 5-MTHF que nous évoquions plus haut.
Une mutation du gène MTHFR peut donc entraîner un déficit en 5-MTHF, qui va alors impacter tout le cycle de méthylation.
La seule manière d’y remédier sera de se supplémenter directement en calcium L-methylfolate, la forme stabilisée du 5-MTHF. En effet, toutes les autres formes de vitamine B9, allant de l’acide folique classique à des formes plus évoluées comme l’acide folinique, devront irrémédiablement passer par l’enzyme MTHFR afin de donner la forme métaboliquement active de folate 5-MTHF.
En bref
Comme évoqué en début d’article, au moins deux facteurs peuvent avoir un impact sur le bon fonctionnement de notre processus de méthylation :
- Il s’agit d’une part de notre alimentation, et il s’agit ici d’éviter les carences en certains nutriments essentiels à ce processus ;
- Et d’autre part de notre patrimoine génétique, qui peut de base nous faire défaut en raison de mutations mettant à mal la bonne marche du processus.
Dans ce dernier cas, une adaptation de notre alimentation sera nécessaire.
Le saviez-vous ?
Dans notre multivitamines nuPower, c’est exactement pour cette raison qu’on utilise justement cette forme métaboliquement active de vitamine B9 : le calcium L-methylfolate. On a d’ailleurs été les premiers à l’intégrer dans notre formulation il y a plus de 10 ans !
Comment assurer un processus de méthylation fonctionnel ?
S’assurer d’avoir tous les nutriments nécessaires à une bonne méthylation
La méthionine est donc la clé de voûte de tous ces processus, mais partant du principe qu’elle se trouve dans toutes les protéines, il est assez rare d’en manquer (ce qui peut malgré tout arriver notamment lorsque notre consommation de protéines n’est pas suffisante, auquel cas c’est la première chose à régler).
La seconde chose la plus importante (et la première en réalité pour la majorité d’entre nous) sera de s’assurer que notre alimentation apporte les nutriments essentiels à la reconversion de l’homocystéine, en particulier : folates, vitamines B12 et B6, choline ou TMG, et glycine.
Où trouver tous ces nutriments nécessaires à la méthylation ?
Les folates
Les folates (ou vitamine B9) se trouvent principalement dans le foie, les légumineuses, ainsi que les légumes feuilles et autres légumes verts (épinards, asperges, brocolis, laitue…) qu’il conviendra de ne pas bouillir pour garder un maximum de folates.
La vitamine B12
La vitamine B12 ne se trouve que dans les produits animaux ou leurs dérivés (puisqu’elle est produite par des bactéries dans le colon), en tête le foie et les fruits de mer (palourdes en particulier), mais toutes les viandes, de même que les œufs et les produits laitiers en contiennent.
La vitamine B6
La vitamine B6 est présente essentiellement dans la viande, la volaille, les abats (foie, rognons, etc.), le poisson, la levure de bière, le jaune d’œuf et les produits laitiers. De fait, on en manque rarement.
La choline
La choline se trouve principalement dans le foie, le jaune d’œuf, et le germe de blé, alors que la TMG (pour rappel la choline peut se convertir en TMG au besoin) se trouve principalement dans le son et le germe de blé, les épinards ou les crevettes.
La glycine
La glycine est très abondante dans les os et la peau, puisqu’elle est l’un des constituants essentiels du collagène. C’est la raison pour laquelle nous recommandons toujours très chaudement de consommer du bouillon d’os, pour ceux qui le peuvent.
Le saviez-vous ?
Encore mieux que la glycine, vous pouvez consommer directement du collagène ! Pour cela, choisissez un collagène Premium, issu de bœuf nourri à l’herbe et élevé en plein air sur pâturage.
Le magnésium
Enfin, toutes ces réactions impliquent régulièrement de l’ATP, qui nécessite du magnésium pour pouvoir être activé.
Le magnésium sera donc également particulièrement important pour assurer une bonne méthylation. On en trouve surtout dans les fruits secs (en particulier les noix du Brésil), les sardines en conserve, les fruits de mer (en particulier les bigorneaux) ainsi que dans la farine de sarrasin (la teneur en magnésium du chocolat reste controversée quant à sa biodisponibilité).
Sans surprise (puisqu’une très grande partie des processus de méthylation y ont lieu), le foie arrive largement en tête des aliments les plus denses nutritionnellement, surtout en regard des nutriments nécessaires à la méthylation. Une petite portion de foie par semaine (ou d’abats en général) pourrait donc être la formule idéale afin de pouvoir dormir tranquille, et ne plus trop se préoccuper de l’apport nutritionnel du reste de notre alimentation !
Les analyses de cycle de méthylation
La science n’en est qu’à ses débuts concernant les analyses ADN en regard de ces processus, bien que certains laboratoires commencent à proposer des analyses concernant la MTHFR.
Aux Etats-Unis, de nombreuses sociétés se sont spécialisées dans l’analyse des enzymes qui sont répertoriées dans les divers cycles de méthylation (et pas uniquement la MTHFR). En utilisant les données brutes issues de l’analyse ADN proposée par le site 23andme, des sites comme promethease, geneticgenie, nutrahacker ou mthfrsupport vous indiquent vos mutations génétiques, avec parfois des pronostics de santé et des conseils de prises de compléments alimentaires souvent très douteux qu’il vaut mieux à notre humble avis ignorer.
À ce jour, la meilleure analyse des cycles cités ci-dessus est proposée par le site seekinghealth et se nomme StrateGene. Cette dernière représente graphiquement les enzymes dans leurs cycles respectifs et vous indique avec des codes couleurs leur niveau d’efficacité.
Ces analyses restent cependant à destination d’un public très éclairé, et compte tenu de la complexité des réactions enzymatiques, il nous semble très hasardeux à l’heure actuelle de pouvoir élaborer des traitements en utilisant ce type d’outils (qui reste à titre informatif très intéressants).
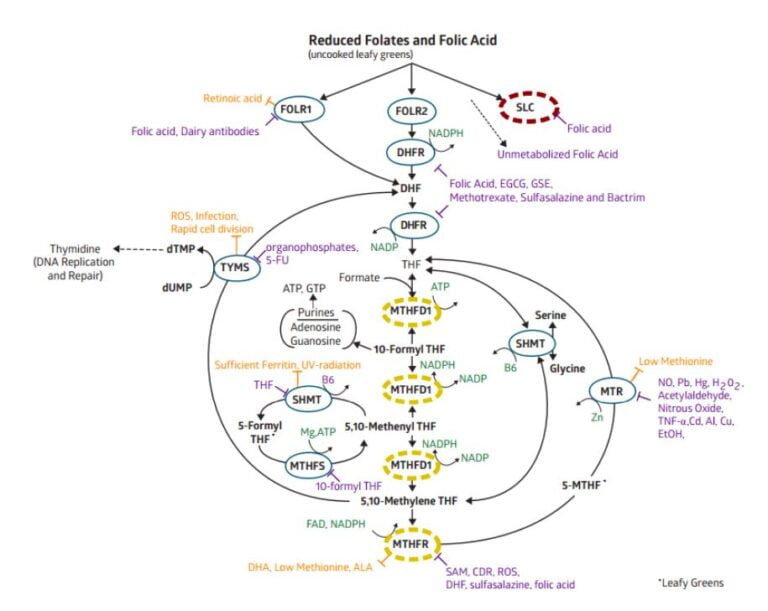
Un exemple d’analyse de cycle de méthylation proposé par StrateGene
En pointillés jaunes, les gènes codants pour ces enzymes présentent une mutation hétérozygote, ce qui modifie quelque peu leur fonctionnement nominal.
En pointillés rouge, la mutation est cette fois homozygote, ce qui perturbe très fortement le fonctionnement nominal de ces enzymes.
Méthylation : le diagnostic du gène MTHFR pour les femmes enceintes
En France, les diagnostics de mutation de la MTHFR sont de plus en plus répandus, en particulier pour les femmes enceintes ou souhaitant procréer, puisqu’un déficit en vitamine B9 peut induire de graves malformations chez le fœtus. Pour cette raison, on supplémente systématiquement la femme enceinte en acide folique. Mais pour les personnes porteuses d’une mutation MTHFR, l’acide folique ne sera vraisemblablement pas métabolisé (ou pas suffisamment), et la carence en vitamine B9 restera probable.
Si vous êtes enceinte ou que vous souhaitez avoir un enfant, n’hésitez pas à demander à votre médecin un diagnostic du gène MTHFR. Sinon dans le doute, choisissez de la vitamine B9 sous forme méthylfolate de calcium.
Le saviez-vous ?
Dans notre multivitamines nuMum spécialement conçu pour les femmes enceintes et allaitantes ou en désir de procréer, on utilise bien sûr aussi la forme métaboliquement active de vitamine B9 (et pas de l’acide folique synthétique).
L’importance de l’hygiène de vie pour une bonne méthylation
Par ailleurs, comme le rappelle le Dr Lynch, créateur de StrateGene, il faut garder en mémoire que le fonctionnement de ces enzymes reste étroitement lié à notre hygiène de vie, car elles aussi obéissent aux lois de l’épigénétique.
En attendant de pouvoir s’appuyer sur cette science nouvelle pour des traitements efficaces et novateurs, à ce jour le plus important en plus d’une alimentation très riche en nutriments qui soutiennent la méthylation, c’est :
- De s’assurer un sommeil suffisant et réparateur ;
- De pratiquer une activité sportive régulière ;
- Et de rester éloigné de toute source de stress et de pollution, car tous ces facteurs influencent fortement nos processus de méthylation.
La méthylation est donc un processus en apparence compliqué, mais en réalité relativement simple, et surtout essentiel, puisqu’il constitue la clé de voûte d’une multitude d’actions vitales au sein de notre organisme. Or, il peut être grandement impacté d’une part par notre alimentation, et d’autre part par notre héritage génétique.
Dès lors, il est primordial en premier lieu de s’assurer d’avoir des apports suffisants en certains nutriments essentiels au bon fonctionnement de ce processus, en particulier les folates, la vitamine B12 et la vitamine B6, la choline, la glycine ou encore le magnésium.
Dans le cas d’une mutation génétique pouvant impacter le processus – ce que l’on peut déceler en faisant un examen de biologie médical (prise de sang), ou via une analyse du séquençage de notre ADN (avec un extrait de salive) – il sera important, en plus de s’assurer d’apports encore plus conséquents en ces nutriments, d’avoir une hygiène de vie la plus saine possible (sommeil, activité sportive, stress, pollution, etc.), le fonctionnement de ces enzymes y étant étroitement lié.
Pourquoi prendre un multivitamines bien formulé ?
Tout simplement parce qu’en parallèle d’une bonne alimentation, c’est le moyen le plus simple et le plus efficace pour faire le plein de tous ces micronutriments essentiels : folates, vitamine B12, vitamine B6, magnésium… et même les cofacteurs nécessaires à la synthèse du fameux glutathion !
FAQ : La méthylation
Qu’est-ce que la méthylation ?
La méthylation est un processus métabolique vital, qui a lieu de manière naturelle tout le temps et partout dans notre organisme. Ce processus consiste en la transmission d’un groupe méthyle (un atome de carbone lié à 3 atomes d’hydrogènes, ou CH3) d’une molécule à une autre.
La méthylation permet à elle seule d’assurer une multitude de fonctions dans le corps humain, comme la production et la régulation de très nombreuses molécules dont des neurotransmetteurs et hormones dans le cerveau, la détoxification du corps via la production de glutathion, la dégradation de l’histamine dans l’intestin. Il permet enfin la modulation de l’expression de certains gènes de notre ADN via des processus épigénétiques.
Un défaut de méthylation peut être la cause d’innombrables symptômes et pathologies sérieuses.
Quels sont les facteurs qui influencent la méthylation ?
Le bon fonctionnement de notre processus de méthylation peut être impacté par au moins deux facteurs :
- D’une part notre alimentation : il s’agit ici d’éviter les carences en certains nutriments essentiels au processus de méthylation (folates, vitamine B12 et B6, choline, glycine, etc.) ;
D’autre part notre patrimoine génétique : il peut faire défaut en raison de mutations qui mettront à mal la bonne marche du processus de méthylation.
Comment assurer un processus de méthylation fonctionnel ?
Pour assurer un processus de méthylation fonctionnel, il est primordial en premier lieu de s’assurer d’avoir des apports suffisants en protéines (pour l’apport en méthionine, qui est au cœur de la méthylation), ainsi qu’en certains nutriments essentiels au bon fonctionnement de ce processus : folates, vitamines B12 et B6, choline, glycine ou magnésium.
Par ailleurs, des mutations génétiques peuvent impacter le processus de méthylation : on peut le déceler en faisant un examen de biologie médical (prise de sang), ou via une analyse du séquençage de notre ADN (avec un extrait de salive). Auquel cas, il est important d’avoir en plus une hygiène de vie la plus saine possible (sommeil, activité sportive, stress, pollution, etc.).
- https://www.inserm.fr/information-en-sante/dossiers-information/epigenetique
- Homocysteine levels in vegetarians versus omnivores. Krajcovicová-Kudlácková M et al. Ann Nutr Metab. 2000;44(3):135-8.
- Plasma total homocysteine status of vegetarians compared with omnivores: a systematic review and meta-analysis. Obersby D et al. Br J Nutr. 2013 Mar 14;109(5):785-94.
Nos conseils et astuces sur la nutrition
Filtre
Calcium et phosphore : un lien d’équilibre important pour garder des os solides
Manque de sommeil et prise de poids : y a-t-il un lien ?
Les bienfaits secrets du bouillon maison